Zellkerntransfer (Somatic Cell Nuclear Transfer (SCNT))
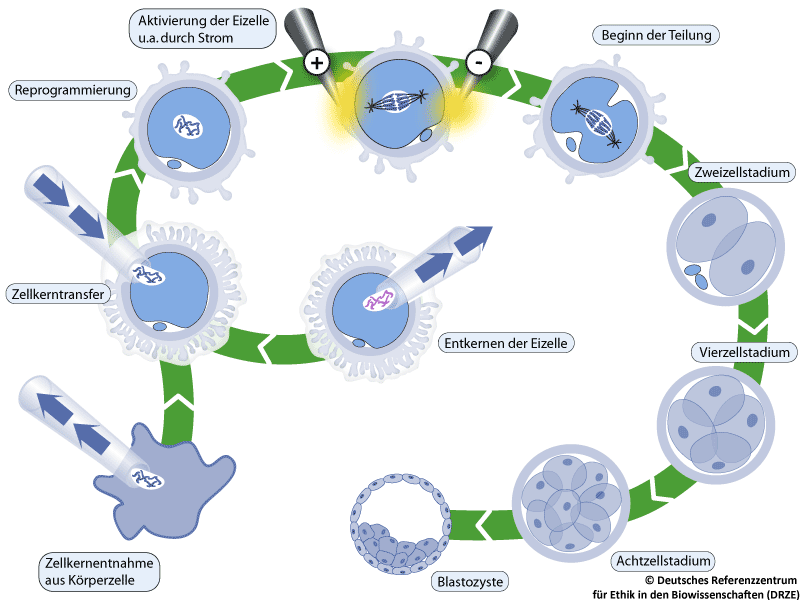
Abbildung 5: Schematische Abbildung eines Zellkerntransfers.
Für das Verfahren des somatischen Zellkerntransfers (engl. somatic cell nuclear transfer (SCNT)) wird zum einen ein Zellkern, zum anderen eine Eizelle ohne eigenen Zellkern benötigt. Die Eizelle wird durch einen minimalinvasiven Eingriff nach einer oft für die spendende Person körperlich belastenden Hormonbehandlung aus den Eierstöcken gewonnen (siehe IVF) und entkernt, indem mit einer Mikropipette der Zellkern abgesaugt wird. Der Zellkern aus einer Körperzelle wird abgesaugt und in das Zytoplasma der entkernten Eizelle injiziert. Der Zellkern kann dabei praktisch aus jeder adulten Körperzelle der Spendenden durch Absaugen mit einer Hohlnadel (Aspiration) isoliert werden. Danach kommt es zur Reprogrammierung, einem noch weitgehend unverstandenen Prozess, bei dem die DNA des eingebrachten Zellkerns ihre Spezialisierung verliert. Dies erfolgt über sogenannte epigenetische Veränderungen: Gensequenzen der DNA, die im Verlauf ihrer Spezialisierung „verpackt” und nicht mehr abgelesen wurden, werden mittels sogenannter Transkriptionsfaktoren wieder aktiviert und abgelesen. Diese Veränderungen sind eine Voraussetzung für die weitere Entwicklung der neu zusammengesetzten Zelle. Nach ihrer Aktivierung durch Strom und verschiedene Mediumzusätze beginnt sich die Eizelle mit dem Körperzellkern in einem Nährmedium zu teilen und kann sich unter gegebenen Umständen bis zur Blastozyste oder noch weiter entwickeln (siehe Abbildung). Aus der Blastozyste können anschließend embryonale Stammzellen gewonnen werden (siehe Abbildung 3).
Die Effizienz der Technik ist insgesamt begrenzt, da die Reprogrammierung in vielen Versuchen nicht abgeschlossen wird und die jeweilige Zelle ihre Spezialisierung nicht vollständig verliert.
Das Verfahren der Herstellung von Säugetier-Embryonen durch die Übertragung des Zellkerns einer adulten Körperzelle auf eine entkernte Eizelle wurde 1997 durch Wilmut et al. erstmals beschrieben, die es bei der Herstellung des Klonschafs Dolly einsetzten. Seither wurde die Methode erfolgreich auch bei anderen Säugetierarten durchgeführt, zum Beispiel berichteten 1998 Wakayama et al. über den erfolgreichen Einsatz einer ähnlichen Technik bei der Maus. Die Methode des reproduktiven Klonens ist insgesamt allerdings mit hohen Missbildungs- und Sterblichkeitsraten verbunden.
Siehe weiterführend:
Nashun, B., Hill, P., & Hajkova, P. (2015). Reprogramming of cell fate: epigenetic memory and the erasure of memories past. The EMBO Journal ,34(10), 1296-1308. https://doi.org/10.15252/embj.201490649
Tachibana, M., Amato, P., Sparman, M., Gutierrez N., Tippner-Hedges, R., Ma, H., Kang, E., Fulati, A., Lee, H.-S., Sritanaudomchai, H., Masterson, K., Larson, J., Eaton, D., Sadler-Fredd, K., Battaglia, D., Wu, D., Jensen, J., Patton, P., Gokhale, S., Stouffer, R., Wolf, D., & Mitalipov, S. (2013). Human Embryonic Stem Cells Derived by Somatic Cell Nuclear Transfer. Cell, 135(6), 1228-1238. https://doi.org/10.1016/j.cell.2013.05.006
Takahashi, K., & Yamanaka, S. (2016). A decade of transcription factor- mediated reprogramming to pluripotency. Nature Reviews Molecular Cell Biology ,17(3), 183-193. https://doi.org/10.1038/nrm.2016.8
Wakayama, T., Perry, A. C. F., Zuccotti, M., Johnson, K. R., & Yanagimachi, R. (1998). Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature, 394, S. 369-373. https://doi.org/10.1038/28615
Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., & Campbell, K. H. S. (1997). Viable offspring derived from fetal and adult mammalian cells. Nature, 385, 810-813. https://doi.org/10.1038/385810a0